Сравнение эффективности комбинаций митоксантрона с преднизолоном и доцетаксела с преднизолоном при гормонорезистентном раке предстательной железы.
В настоящее время изучение механизмов развития и разработка наиболее эффективных методов лечения гормонорезистентного рака предстательной железы (ГРПЖ) — одна из наиболее актуальных проблем, стоящих перед онкологами и урологами во всем мире.
Как известно, более чем у 80% пациентов с распространенным раком предстательной железы путем блокады андрогенов удается достичь стабилизации заболевания. Среднее время до прогрессирования после гормонотерапии у этих больных составляет около 2 лет. Несмотря на кастрационный уровень тестостерона (<50 нг/дл), почти у 80% этих пациентов в течение 12—18 мес наступает прогрессирование заболевания — развитие ГРПЖ . Дальнейшее лечение имеет, как правило, симптоматический характер и включает в себя применение наркотических анальгетиков, глюкокортикостероидов — ГКС (преднизолон, гидрокортизон), бисфосфонатов, дистанционной лучевой терапии на наиболее болезненные участки костного метастазирования, радиофармтерапии Sm153 или Str89.
В то же время современные химиотерапевтические препараты увеличивают продолжительность и улучшают качество жизни пациентов, позволяют добиться регресса со стороны пораженных лимфатических узлов, снизить уровень простатспецифического антигена (ПСА). За прошедшее десятилетие изучалась эффективность различных комбинаций цитостатиков и ГКС. Наиболее перспективными оказались схемы: митоксантрон с преднизолоном, а в последнее время — доцетаксел с эстрамустином или ГКС.
Целью нашего рандомизированного исследования было изучение сравнительной эффективности схем лечения с использованием митоксантрона и доцетаксела.
В исследование было включено 52 пациента с ГРПЖ, проходивших лечение в урологическом отделении ГУ МРНЦ с 2000 по 2004 г. Больные были рандомизированны на 2 группы. 1-я группа (26 больных) получала доцетаксел + преднизолон; 2-я группа (26 больных) — митоксантрон + преднизолон. Возраст больных колебался от 47 до 78 лет (средний возраст — 63 года). У всех пациентов на момент начала лечения имелось гистологическое подтверждение диагноза рака предстательной железы. В большинстве случаев это были низкодифференцированная — у 21 (80,8%) больного 1-й группы и недифференцированная — формы у 23 (88,5%) больных 2-й группы.
У 24 пациентов определялись костные метастазы, у 9 — метастазы в регионарные и отдаленные лимфатические узлы и у 19 — поражение лимфатических узлов и костей скелета. Уровень тестостерона у всех пациентов был ниже кастрационного (<8,7 нмоль/л). У большинства больных уровень ПСА достигал 50 нг/мл и более (при норме — до 4нг/мл): у 15(57,7%) пациентов 1-й группы и у 14(53,9%) — 2-й. Уровень ПСА < 10нг/мл наблюдался у 4(15,4%) больных 1-й группы и у 3 (11,5%) — 2-й.
До развития ГРПЖ гормональную терапию (двусторонняя орхэктомия и антиандрогенная блокада) получили 47 больных, лечение LH-RH-аналогами и антиандрогенами — 11, эстрогенотерапию — 5, химиотерапию 17.
24 больным в прошлом проводилась дистанционная лучевая терапия, из них у 17 на область предстательной железы и у 7 — на наиболее болезненные участки костных метастазов. Лечение радиофармпрепаратами (Sm153 или Str89) до включения в исследование получили 2 больных.
Мы изучали качество жизни больных ГРПЖ по таким показателям, как статус активности и уровень болевого синдрома. Принимали во внимание только медицинскую составляющую такого многофакторного понятия, как качество жизни, не учитывая его социальную и эмоциональную стороны.
У 41 больного статус активности по версии ВОЗ равнялся 1, у 7 — 2 и у 4 — 3. Распределение пациентов по болевой шкале ВОЗ было следующим: у 11 больных уровень боли соответствовал 0, у 21 — 1, у 16 — 2 и у 4 — 3. Таким образом, более 50 (78,8%) пациентов имели в той или иной мере выраженный болевой синдром, требующий приема анальгетиков. В табл. 1 представлена характеристика больных до начала лечения. Таблица 1. Характеристика больных до лечения
Показатель |
Митоксантрон +преднизолон |
Доцетаксел +преднизолон |
Количество пациентов |
26 |
26 |
Средний возраст, годы |
63 |
62,5 |
Статус активности,ВОЗ 0 1 2 3 |
- 20 3 3 |
- 21 4 1 |
Уровень боли,ВОЗ 0 1 2 3 4 |
6 11 8 1 - |
5 10 8 3 - |
Средний уровень: ПСА, нг/мл Тестостерон, нмоль/л |
196,7 (3,81- 1152,5) 0,46 |
214,5 (0,39- 1380) 0,89 |
Участки метастазирования: лимфатические узлы; кости; лимфатические узлы+кости |
5 11 10 |
4 11 11 |
Предшеств.гормонотерапия: орхэктомия+антиандрогены; LH-RH-агонисты+ антиандрогены; эстрогенотерапия; |
25 7 4 |
22 4 1 |
Предшеств.лучевая терапия: на предстательную железу; паллиативная на кости; радиофармпрепараты; |
10 2 - |
7 5 2 |
Предшеств. химиотерапия |
8 |
9 |
После завершения обследования и рандомизации пациенты начинали получать лекарственную терапию по одной из схем: больным 1-й группы назначали митоксантрон внутривенно капельно в дозе 12 мг/м2 каждый 21 день; пациентам 2-й группы — доцетаксел в дозе 75 мг/м2 внутривенно капельно. Преднизолон в дозе 10 мг/сут больные обеих групп получали ежедневно на протяжении всего курса лечения.
C целью профилактики возникновения реакций гиперчувствительности и синдрома задержки жидкости пациенты получали дексаметазон в дозе 8 мг внутримышечно за 12 и 6 ч до введения доцетаксела и внутривенно капельно за 30 мин до его введения. Для предотвращения нежелательных реакций гиперчувствительности пациентам назначали также димедрол 50 мг и ранитидин 50 мг (либо фамотидин 20 мг) внутривенно капельно за 30 мин до инфузии доцетаксела.
В 1-й группе больных проведено 119 циклов химиотерапии (от 1 до 10, в среднем — 5). 22 (84%) пациента получили 3 и более цикла химиотерапии, 4 (16%) — менее 3 циклов: 3 (12%) — 2 цикла и 1 (4%) — 1 цикл ввиду прогрессирования основного заболевания.
Во 2-й группе (митоксантрон + преднизолон) 20 (76,9%) больным проведено 3 и более цикла химиотерапии, 6 (23,1%) — 2 и менее. Всего в этой группе было проведено 120 циклов химиогормонотерапии.
Результаты лечения пациентов обеих групп представлены в виде сравнительной оценки показателей выживаемости, объективного ответа со стороны пораженных лимфатических узлов и костей скелета, изменения уровня ПСА, а также качества жизни.
При сопоставлении средней продолжительности жизни больных в двух группах отмечено преимущество схемы, включающей доцетаксел: 13,3 мес (399 дня) против 9,8 мес (294 дня), показатели скорректированной выживаемости также говорят о преимуществе терапии, которую получали больные 1-й группы (рис. 1).
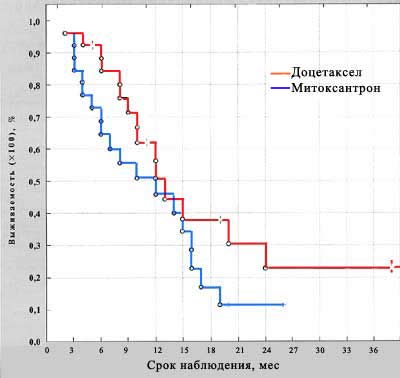
Рис. 1. Выживаемость в группах больных, леченных доцетакселом и митоксантроном
Как видно на графике, показатели 12-месячной выживаемости составили 50,6% в группе доцетаксела и 45,83% в группе митоксантрона, а показатели 2-летней выживаемости — 30,37 и 11,45% соответственно.
При анализе показателей скорректированной безрецидивной выживаемости в обеих группах наблюдалась схожая тенденция: 1-годичная скорректированная безрецидивная выживаемость в группе доцетаксела составила 25,64%, в группе митоксантрона — только 7,61 (рис. 2).
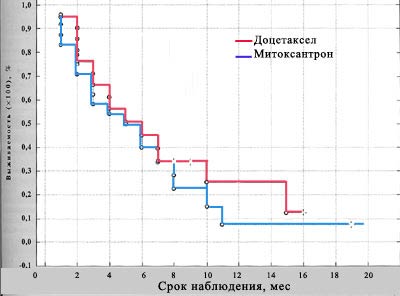
Рис. 2. Показатели выживаемости до прогрессирования болезни в группах больных, леченных доцетакселом и митоксантроном
Мы также проводили анализ прогностических факторов, влияющих на выживаемость, с использованием модели пропорциональных интенсивностей Кокса (табл. 2).
Таблица 2. Результаты анализа прогностических факторов, влияющих на общую выживаемость в группах больных, получавших доцетаксел и митоксантрон
Прогностический фактор |
P |
Стадия Т |
0,856594 |
Время до развития ГРПЖ |
0,820766 |
Уровень ПСА: до лечения после лечения |
0,319037 0,039835 |
Максимальное снижение уровня ПСА |
0,124187 |
Время до прогрессирования уровня ПСА |
0,222921 |
Из табл. 2 видно, что основным фактором, влияющим на выживаемость больных в обеих группах, был уровень ПСА после окончания лечения (p=0,039835). Основным фактором, определяющим безрецидивную выживаемость в обеих группах, было время до прогрессирования уровня ПСА (p=0,015555; табл. 3).
Таблица 3. Результаты анализа прогностических факторов, влияющих на безрецидивную выживаемость в группах больных, получавших доцетаксел и митоксантрон
Прогностический фактор |
Р |
Стадия Т |
0,459307 |
Время до развития ГРПЖ |
0,594064 |
Уровень ПСА: до лечения после лечения |
0,391578 0,104382 |
Максимальное снижение уровня ПСА |
0,554367 |
Время до прогрессирования уровня ПСА |
0,015555 |
При сравнении результатов объективного ответа со стороны пораженных лимфатических узлов у больных 1-й группы (доцетаксел) отмечался несколько более выраженный эффект, чем у пациентов 2-й группы (митоксантрон), — 61,5 против 45,5%. Стабилизация костного метастазирования зарегистрирована в 68% случаев у больных, 1-й группы и в 50% случаев у пациентов 2-й (табл. 4).
Таблица 4. Динамика со стороны пораженных лимфатических узлов и костей скелета в ответ на лечение доцетакселом и митоксантроном
Группа больных |
1-я группа (доце-таксел) |
2-я группа (митоксан-трол) |
ПР |
1(7,5) |
1(9,1) |
ЧР |
3(23) |
2(18,2) |
Стабилизация |
4 (31,0) |
2 (18,2) |
ВСЕГО |
8 (61,5) |
5 (45,5) |
Стабилизация костных метастазов |
15 (68) |
8 (50) |
Применение. ПР-полная, ЧР-частичная регрессия. Здесь и в табл. 6,7: в скобках — процент больных.
Снижение уровня ПСА было более выраженным у пациентов 1-й группы — 52,2%, чем у больных 2-й группы, — 41,7%. Средняя продолжительность ответа по ПСА колебалась от 4 до 8,6 мес и достоверно не различалась в обеих группах (табл. 5).
Таблица 5. Продолжительность безпрогрессивного ответа по ПСА при лечении доцетакселом и митоксантроном
Группа больных |
1-я группа (доце- таксел) |
2-я группа (митоксан -трол) |
Количество пациентов |
23 |
24 |
Снижение уровня ПСА >50%, % |
52,2 |
41,7 |
Продолжительность ответа, мес |
6,8 |
6,3 |
|
Снижение уровня ПСА>80%, % |
21,7 |
16,6 |
Продолжительность ответа, мес |
8,6 |
8,5 |
|
Стабилизация уровня ПСА, % |
8,7 |
16,6 |
Продолжительность ответа, мес |
7 |
4 |
При оценке качества жизни больных ГРПЖ основное внимание уделялось уровню болевого синдрома и статусу активности в соответствии с критериями ВОЗ. Сравнительный анализ полученных результатов показал преимущество схемы лечения доцетакселом. Следует отметить снижение градации болевого синдрома у 14 (53,8%) из 26 пациентов, леченных доцетакселом по сравнению с получавшими митоксантрон. У пациентов 2-й группы не удалось добиться существенного снижения интенсивности болевого синдрома (количество больных, которым не требовались обезболивающие препараты, увеличилось на 15,4%, в то же время на 15,4% возросло число пациентов, получающих наркотические анальгетики; табл. 6).
Таблица 6. Сравнительная характеристика болевого статуса у больных, леченных доцетакселом и митоксантроном
Болевой статус |
1-я группа (доцетаксел) |
2-я группа (митоксантрон) |
0 — анальгетики не требуются |
17(65,4) |
11(42,3) |
1 — иногда ненаркотические |
7(26,9) |
7(26,9) |
2 — регулярно ненаркотические |
2(7,7) |
2(7,7) |
3 — иногда наркотические |
0 |
5(19,3) |
4 — регулярно наркотические |
0 |
1(3,8) |
Статус активности больных в обеих группах претерпел схожие изменения. Применение доцетаксела и преднизолона позволило повысить статус активности у 7,7% пациентов. В группе, леченной митоксантроном и преднизолоном этот показатель улучшился у 7,7% больных и у стольких же пациентов он снизился (табл. 7).
Таблица 7. Сравнительная характеристика статуса активности в группах больных, получавших доцетаксел и митоксантрон
Статус активности |
1-я группа (доцетаксел) |
2-я группа (митоксантрон) |
0 — способен к любой деятельности |
0 |
2(7,7) |
1 — способен к легкому труду |
23(88,5) |
15(57,7) |
2 — более 50% времени на ногах |
2(7,7) |
4(15,4) |
3 — менее 50% времени на ногах |
1(3,8) |
3(11,4) |
4 — необходим постельный режим |
0 |
2(7,7) |
Побочные эффекты лечения в нашем исследовании были представлены явлениями гематологической и негематологической токсичности. Во 2-й группе основным проявлением гематологической токсичности была анемия (у 26,9% пациентов). Негематологическая токсичность характеризовалась кардиотоксичностью, проявлявшейся в большинстве случаев ухудшением показателей ЭКГ: снижением вольтажа зубцов, увеличением интервала PQ. Лишь у 1 (3,8%) больного диагностировано клиническое ухудшение течения ишемической болезни сердца, потребовавшее интенсивной кардиотропной терапии и прекращения лечения после 4 циклов. Снижение аппетита отмечено в 30,8% случаев, диарея 1—2 степени токсичности наблюдалась у 3 больных, явления запора — у 2. Нежелательные реакции — утомляемость и алопеция — зарегистрированы в 46 и 11,5% случаев.
У больных 1-й группы (доцетаксел) ни в одном случае не потребовалось снижения дозы химиопрепарата из-за гематологической токсичности. Снижение уровня Hb на фоне лечения наблюдалось у 19,2% больных. При этом анемия 1-й степени отмечалась в 11,5% случаев, 3-й степени — в 7,7%. У большинства пациентов уровень Hb восстанавливался через 1—2 мес после окончания химиотерапии. Из явлений негематологической токсичности следует отметить алопецию 2—3-й степени (69% случаев), диарею 1-й (34,6%) и 2-й (3,8%) степени токсичности; утомляемость зарегистрирована у 14 пациентов. Синдром задержки жидкости, характерный для химиотерапии доцетакселом, наблюдался у 19,2% больных.
Проведенное рандомизированное исследование эффективности комбинации доцетаксела с преднизолоном (1-я группа) и митоксантрона с преднизолоном (2-я группа) показало, что средняя продолжительность жизни у больных 1-й группы составила 13,3 мес против 9,8 мес во 2-й группе, показатели скорректированной выживаемости также были достоверно выше в 1-й группе. Схема с использованием доцетаксела имеет преимущество и по частоте регрессии со стороны пораженных лимфатических узлов, наблюдаемой в 61,5% случаев: у 3 (23%) больных зарегистрирована ЧР, у 1 (7,5%) — ПР и у 4 (31,0%) — стабилизация метастатического процесса в лимфатических узлах. В группе с митоксантроном этот показатель составил 45,5%. Снижение уровня ПСА >50% от исходного удалось достигнуть у 52,2% больных при использовании доцетаксела, в то время как при лечении митоксантроном — только у 41,7% больных.
Применение схемы с доцетакселом позволило на 46,1% увеличить количество пациентов, которым не требовались анальгетики на фоне проводимой терапии. В то же время полностью отказаться от приема наркотических препаратов смогли 11,5% больных. Следует отметить снижение градации болевого синдрома у 53,8% (14 из 26) пациентов в группе доцетаксела. Положительная динамика в данной группе проявилась и в изменении статуса активности больных: применение доцетаксела и преднизолона позволило повысить этот показатель у 7,7% пациентов.
Благодаря достижениям молекулярной медицины появляется все больше данных о природе и течении ГРПЖ. Активно изучаются "лекарства-мишени" и их комбинации с уже известными цитостатиками. Разработка новых схем лечения и внедрение их в клиническую практику позволяют надеяться на улучшение результатов лечения этого заболевания.
Авторы: В.А. Бирюков, О.Б. Карякин, Т.В. Свиридова, Н.Г. Минаева, Е.А. Доничкина, М.А. Перехрест ГУ МРНЦ РАМН, Обнинск
|