Значение уровня тимидилатсинтетазы для прогноза и эффекта химиотерапии при
колоректальном раке
О.В.Абсалямова, Е.В.Степанова, М.Р.Личиницер
Российский
онкологический научный центр им. Н.Н.Блохина РАМН, Москва
В химиотерапию колоректального рака в последние годы вошел ряд
новых активных препаратов, таких как оксалиплатин, томудекс, иринотекан,
капецитабин и др. В настоящее время активно изучаются новые биохимические
опухолевые маркеры, способствующие выбору рациональной
химиотерапии.
Тимидилатсинтетаза (ТС) является одним из
ключевых ферментов, контролирующих репликацию ДНК [1]. Этот фермент катализирует
превращение дезоксиуридина монофосфата в дезокситимидин монофосфат, который
является единственным источником синтеза тимидина, начальным предшественником
для репликации ДНК. ТС является мишенью для ингибирования некоторых
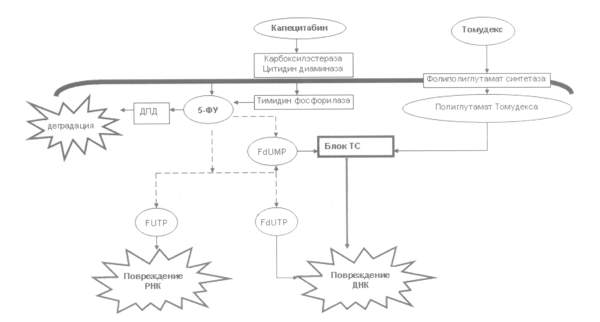
противоопухолевых препаратов, в частности 5-ФУ и томудекса (см.
рисунок).
5-ФУ является непрямым ингибитором ТС, метаболиты
которого необратимо с ним связываются, блокируя деление клеток. Активные
метаболиты 5-ФУ: 5-фтордезоксиуридин монофосфат (FdUMP), 5-фторуридин трифосфат
(FUTP) и 5-фтордезоксиуридин трифосфат (FdUTP) ответственны за противоопухолевый
эффект препарата [2]. FdUMP связывается с ТС, препятствуя синтезу тимидина
трифосфата. FdUTP инкорпорируется в ДНК, приводя к ее разрывам. FUTP
инкорпорируется в РНК, вызывая нарушения ее стабильности и функции. При
повреждении ДНК и РНК одним из основных механизмов апоптоза является
стабилизация р53 [3].
Томудекс – прямой и специфический
ингибитор ТС, проникает в опухолевую клетку с помощью восстановленного
переносчика фолатов – фолиполиглутаматсинтетазы, инициирующей реакцию
полиглутамации томудекса, который более чем в 70 раз сильнее блокирует ТС, чем
первичное соединение [4].
Капецитабин также является
ингибитором ТС. В результате двух этапов его биохимического превращения он
избирательно накапливается в опухоли под влиянием тимидинфосфорилазы, образуя
5-ФУ, взаимодействующий с ТС.
Экспрессия ТС и безрецидивная выживаемость больных колоректальным раком
стадий B и С (по Duke)
|
Стадия |
Статус ТС |
Безрецидивная выживаемость |
p |
|
5-летняя выживаемость, % |
медиана, мес |
|
|
B |
ТС– |
80,5 |
– |
0,048 |
|
ТС+ |
47,1 |
36 |
|
|
C |
ТС– |
34,8 |
15 |
0,7 |
|
ТС+ |
21,4 |
25 |
|
ТС как мишень действия противоопухолевых препаратов.
FdUMP – 5-фтордезоксиуридин монофосфат, FdUTP – 5-фтордезоксиуридин
трифосфат, FUTP – 5-фторуридин трифосфат, 5-ФУ – 5-фторурацил, ДПД –
дегидропиримидин дегидрогеназа, ТС – тимидилатсинтетаза.
Методика исследования
Уровень ТС в опухоли
определяли с помощью иммуногистохимии, используя коммерческие моноклональные
антитела к ТС клон TS-106, Chemicon, которые являются “золотым стандартом” среди
антител к ТС. Поскольку невысокий уровень ТС может экспрессироваться и в
нормальных тканях, важным является выбор адекватных критериев оценки окрашивания
антителами к ТС. В большинстве работ, посвященных исследованию уровня ТС, при
колоректальном раке используются следующие критерии оценки [5,
6]:
0 – отсутствие окрашивания или окрашивание с любой
интенсивностью менее 20% опухолевых клеток;
1+ – слабое
окрашивание цитоплазмы более 25% опухолевых клеток;
2+ –
среднее окрашивание цитоплазмы более 25% опухолевых
клеток;
3+ – сильное окрашивание цитоплазмы более 25%
опухолевых клеток.
Опухоли, оцениваемые как 2+ и 3+,
являются положительными по экспрессии ТС.
Для определения
уровня транскрипции ТС все чаще используют обратную транскриптазную ПЦР в
реальном времени, которая позволяет количественно определить уровень мРНК в
цитозоле клеток. Этот метод позволяет наиболее точно оценить уровень мРНК ТС на
небольшом количестве материала (например, при пункции или биопсии). Однако
требуется тщательный контроль взятого материала: образец пригоден для
исследования, если содержит более 80% опухолевых клеток при цитологическом
исследовании [7, 8]. К недостаткам этого метода относятся также необходимость
дорогостоящего оборудования и высокая стоимость исследования. Недавно был описан
метод выделения опухолевых клеток из срезов с парафиновых блоков путем
микродиссекции с последующим проведением количественной ПЦР, при этом точность
определения уровня ТС составила более 80% [9].
Другим
используемым методом является определение количества специфических повторов в
промотере гена ТС [10, 11]. Увеличение синтеза ТС часто связано с полиморфизмом
энхансер-региона промотера (который определяет активность трансляции мРНК с
гена). Промотер ТС состоит из 28 пар оснований, обычно присутствующих как
двойной тандем повторов (TSER*2) или тройной тандем повторов (TSER*3).
Исследования in vitro показали, что 3 копии повторов усиливают синтез мРНК ТС
более чем в 2,6 раза. Показано также, что TSER*3/TSER*3 опухоли резистентны к
5-ФУ. Меньшей резистентностью обладают гетерозиготы TSER*3/TSER*2, тогда как
гомозиготы TSER*2/TSER*2 хорошо поддаются лечению
[10].
Какой из методов определения ТС в опухоли является
лучшим? Отдельные исследования показали, что измерение уровня мРНК на
свежезамороженном материале сильно коррелирует с уровнем белка, измеренным с
помощью Вестерн-блоттинга, или с функциональной активностью ТС (связывание
fdUMP) [12, 13]. Также отдельные исследования сообщают о соответствии уровня
мРНК ТС, измеренной с помощью количественной ПЦР, с уровнем белка, определенным
с помощью иммуногистохимии (ИГХ) на парафиновых блоках. Метод ИГХ обладает
неоспоримым преимуществом – возможностью проведения исследования на парафиновых
блоках, однако он требует дальнейшей стандартизации (используемые антитела,
критерии оценки и т.д.).
Экспрессия ТС при колоректальном раке
Повышенная
экспрессия ТС в ткани первичной опухоли колоректального рака обнаружена в 44%
случаев. При этом она коррелировала с накоплением общего р53 (r=0,48; p=0,001).
Экспрессия ТС была выше у больных со стадией заболевания C (62%) по сравнению с
больными со стадией B (32%).
Уровень ТС играет важную
прогностическую роль не только для больных, получающих химиотерапию на основе
5-ФУ и томудекса, но и для больных после хирургического лечения. Это может
объясняться тем, что уровень ТС опосредованно связан с пролиферативной
активностью клетки. Высокая пролиферативная активность клеток часто
непосредственно определяет прогноз заболевания. Длительность безрецидивного
периода после радикального удаления опухоли была больше у больных с низким
уровнем ТС в опухоли [14, 15]. По нашим данным, гиперэкспрессия ТС связана с
уменьшением безрецидивной и общей выживаемости больных колоректальным раком
стадий В и С, не получавших адъювантного лечения (см. таблицу). При
гиперэкспрессии ТС медиана безрецидивной выживаемости больных составила 26 мес,
в то время как при низкой экспрессии медиана достигнута не была (p=0,02). Общая
выживаемость больных с гиперэкспрессией ТС составила всего 59 мес, а при низкой
– 178 мес (p=0,03).
Показано, что уровень ТС выше в
колоректальных опухолях типа аденокарциномы с большим выделением слизи
[16].
Проведены исследования корреляции уровня ТС первичной
опухоли и метастазов, для прогнозирования эффективности химиотерапии после
удаления первичной опухоли. Однако существенной корреляции между уровнем ТС
первичной опухоли и метастазов не получено [15, 17, 18]. Замечено, что уровень
мРНК ТС оказался выше в метастазах в лимфоузлы и легкие, чем в соответствующей
первичной опухоли, тогда как метастазы в печень имели более низкую экспрессию
ТС. Эти результаты показывают, что экспрессия в первичной опухоли ТС не может
влиять в достаточной степени на лечебное решение при использовании ингибиторов
ТС. Не все исследователи согласны с таким утверждением. Недавно было показано,
что по полуколичественному определению мРНК ТС и дегидропиримидин дегидрогеназы
(ДПД) в первичной опухоли можно предсказать эффективность химиотерапии УФТ при
метастазах в печени. По нашим данным, в 70% случаев колоректального рака
наблюдается соответствие экспрессии в первичной опухоли и метастазах в лимфоузлы
и печень, определенных
иммуногистохимически.
Эффективность химиотерапии и
уровень ТС. Большинство исследований показывает, что колоректальный рак с
высоким уровнем содержания ТС плохо поддается лечению инфузиями 5-ФУ, опухоли же
с низким ее содержанием – хорошо [19]. Частота встречаемости таких
высокочувствительных опухолей с низким уровнем ТС составляет от 15 до 20%.
Считается, что эффективность 5-ФУ у больных с низким уровнем ТС в 3 раза выше по
сравнению с ТС-положительными больными.
Однако не все
исследования подтверждают корреляцию между высоким уровнем ТС и резистентностью
к 5-ФУ. Имеются сообщения о том, что экспрессия ТС не влияет на успех
химиотерапии [10, 17, 10–22]. Есть парадоксальное сообщение, что высокий уровень
ТС отрицательно сказывается на эффективности лечения, в то время как очень
высокий – дает хорошие результаты [23].
Подобные
разногласия могут быть связаны с малым числом наблюдений в исследованиях и
статистической недостоверностью, но заставляют задуматься и о том, что не только
уровень ТС влияет на успех химиотерапии. Ведется поиск и других факторов
резистентности. Другой причиной вариабельности может быть режим введения 5-ФУ.
Краткосрочное (струйное) введение 5-ФУ с или без лейковорина может в большей
степени повреждать мРНК, а не ДНК, как при длительных инфузиях [24]. Возможно,
эффективность краткосрочных введений 5-ФУ менее зависима от уровня ТС в
опухолевых клетках.
Маркером чувствительности или
резистентности к 5-ФУ является также ДПД, которая инактивирует 5-ФУ [3].
Делались попытки определить корреляцию между уровнем ТС и ДПД в ткани КРР, но
таковой обнаружено не было [25]. Одновременно достоверно показано, что высокий
уровень ДПД снижает эффективность терапии 5-ФУ. Установлено, что больные
ТС-отрицательные и ДПД-отрицательные наиболее часто отвечают на терапию
5-ФУ.
При использовании прямого ингибитора ТС томудекса
показано, что больные с низким уровнем ТС имели высокую эффективность лечения
томудексом и значительное увеличение выживаемости (при низком уровне мРНК ТС –
21,7 мес, при высоком уровнем – 5,7 мес). При этом уровень ДПД не влиял на
эффективность терапии томудексом [26].
Исследуется роль р53
как одного из звеньев в цепи реакций, приводящих в конечном итоге к гибели
клетки. Как известно, существует дикий и мутантный тип р53. Если клетка содержит
дикий тип, то в ней в ответ на повреждение ДНК или образование мутаций
запускается апоптоз. Если же в клетке содержится мутантный р53, то апоптоза
поврежденной клетки не происходит. Это является как одним из факторов
образования опухоли, так и фактором развития резистентности к химиотерапии, так
как при наличии мутантного р53 в клетке не происходит апоптоз в ответ на
воздействие 5-ФУ [27]. Имеются исследования, направленные на установление связи
между уровнем ТС и экспрессией р53 [16, 28]. Показано, что мутантный тип р53
активирует синтез ТС.
Интересные сведения получены при
изучении роли тимидина как опухолевого протектора против воздействия томудекса
[29]. Показано, что высокий уровень тимидина нивелирует эффект томудекса, т.е.
опухоль использует тимидин для своей защиты. Тимидин с помощью тимидинкиназы
превращается в dTMP, что делает бесполезной ингибицию
ТС.
Активно изучаются подходы к снижению уровня ТС в
опухолевых клетках. Использование оксалиплатина в комбинации с 5-ФУ позволяет
преодолеть химиорезистентность, вызванную ТС. Показано, что оксалиплатин может
снижать экспрессию ТС, чем объясняется эффективность режима
оксалиплатин+5-ФУ+лейковорин в случаях, прежде неэффективно леченных
5-ФУ+лейковорин [30]. В наших исследованиях также доказана высокая эффективность
этого режима при ТС-положительном метастатическом раке
[31].
Другой путь снижения ТС связан с использованием
бутирата – регулятора синтеза ДНК. Бутират выделен из клеток слизистой оболочки
ободочной кишки. Доказано, что его комбинация с 5-ФУ дает снижение активности ТС
на 75%, при этом активируется апоптоз опухолевых клеток и замедляется их
пролиферация. Бутират способен также потенцировать эффект лечения томудексом
[32].
Усиление эффекта томудекса при колоректальном раке
может быть достигнуто при дополнительном влиянии на трансляцию ТС [8]. Для
воздействия на процесс трансляции мРНК ТС предложено использовать
олигорибонуклеотид – HYBO432. Его действие нацелено на регуляторный элемент 5’
конца РНК (нуклеотиды 80–109) [33]. Препарат ISIS 13783 является антисмысловым
олигонуклеотидом ТС, который снижает уровень экспрессии ТС на
70%.
Заключение
ТС является одним из наиболее значимых
биохимических и молекулярно-биологических маркеров при колоректальном раке. Его
определение в ткани опухоли помогает определить риск метастазирования после
удаления первичной опухоли, выбрать наиболее эффективную терапию. Ингибиторы ТС
занимают значительное место в химиотерапии колоректального рака. Сегодня активно
разрабатываются подходы к снижению уровня белка в опухоли, что позволит более
эффективно лечить больных, резистентных к традиционной терапии 5-ФУ+лейковорин.
Использование дополнительных исследований ТС, ДПД у больных колоректальным раком
позволит значительно усилить лечебную эффективность у каждого индивидуального
больного.
Работа выполнена при поддержке федеральной
программы “Исследования и разработки по приоритетным направлениям развития науки
и техники гражданского значения” в рамках проекта “Разработка новых методов
лекарственной терапии больных злокачественными заболеваниями на основе анализа
ангиогенных свойств опухоли”.
Литература
1. Danenberg PV. Thymidylate synthase: a target enzyme in
cancer chemotherapy. Biochim Biophys Acta 1977; 473: 73–92.
2. Longley D,
Harkin DP, Johnston PG. 5-fluorouracil: mechanisms of action and clinical
strategies. Nature Rew 2003; 3 (5): 330–8.
3. Diasio RB. Clinical
implications of dihydropyrimidine dehydrogenase on 5–FU pharmacology. Oncology
(Huntingt) 2001; 15 (Suppl. 2): 21–6; discussion 27.
4. Jackman AL, Taylor
GA, Gibson W et al. ICI D1694, a quinazonile antifolate thymidylate syntase
inhibitor that is a potent inhibitor of L1210 tumor cell growth in vitro and in
vivo: a new agent for clinical study. Cancer Res 1991; 51: 5579–86.
5.
Cascinu S, Aschele C, Barni S et al. Thymidylate synthase protein expression in
advanced colon cancer: correlation with the site of metastasis and the clinical
response to leucovorin-modulated bolus 5-fluorouracil. Clin Cancer Res 1999; 5:
1996–9.
6. Johnston PG, Fisher ER, Rockette HE et al. The role of thymidylate
synthase expression in prognosis abd outcome of adjuvant chemotherapy in
patients with rectal cancer. J Clin Oncol 1994; 12: 2640–7.
7. Fujiwara H,
Terashima M, Irinoda T et al. Quantitative measurement of thymidylate synthase
and dihydropyrimidine dehydrogenase mRNA level in gastric cancer by real-time
RT-PCR. Jpn J Cancer Res 2002; 93 (12): 1342–50.
8. Leichman CG, Lenz HJ,
Leichman L et al. Quantitation of intratumoral thymidylate synthase expression
predicts for disseminated colorectal cancer response and resistance to
protracted-infusion fluorouracil and weekly leucovorin. J Clin Oncol 1997; 15:
3223–9.
9. Salonga D, Danenberg KD, Johnson M et al. Colorectal tumors
responding to 5-fluororacil have low gene expression levels of dehydropyridimine
dehydrohenase, thymidylate synthase, and thymidine phosphorylase. Clin Cancer
Res 2000; 6: 1322–7.
10. Iacopetta B, Grieu F, Joseph D, Elsaleh H. A
polymorphism in the enhancer region of the thymidylate synthase promoter
influences the survival of colorectal cancer patients treated with
5-fluorouracil. Br J Cancer 2002; 86 (8): 1365.
11. Kawakami K, Salonga D,
Park JM et al. Different lengths of a polymorphic repeat sequence in the
thymidylate synthase gene affect translational efficiency but not its gene
expression. Clin Cancer Res 2001; 7: 4096–101.
12. Johnston PG, Drake JC,
Trepel J, Allegra C. Immunological quantitation of thymidylate synthase using
the monoclonal antibody TS 106 in 5-fluorouracil-sensitive and -resistant human
cancer cell lines. Cancer Res 1992 Aug.; 52: 4306–12.
13. Johnston PG, Lenz
HJ, Leichman CG et al. Thymidylate synthase gene and protein expression
correlate and are associated with response to 5-fluorouracil in human colorectal
and gastric tumors. Cancer Res 1995; 55: 1407–12.
14. Cascinu S, Graziano F,
Valentini M et al. Vascular endothelial growth factor expression, S-phase
fraction and thymidylate synthase quantitation in node-positive colon cancer:
relationships with tumor recurrence and resistance to adjuvant chemotherapy. Ann
Oncol 2001; 12 (2): 239–44.
15. Tomiak A, Vincent M, Earle CC et al.
Thymidylate synthase expression in stage II and III colon cancer: a
retrospective review. Am J Clin Oncol 2001; 24 (6): 597–602.
16. Wong NA,
Brett L, Stewart M et al. Nuclear thymidylate synthase expression, p53
expression and 5FU response in colorectal carcinoma. Br J Cancer 2001; 85 (12):
1937–43.
17. Aschele C, Debernardis D, Tunesi G et al. Thymidylate synthase
protein expression in primary colorectal cancer compared with the corresponding
distant metastases and relationship with the clinical response to
5-fluorouracil. Clin Cancer Res 2000; 6 (12): 4797–802.
18. Corsi DC,
Ciaparrone M, Zannoni G et al. Predictive value of thymidylate synthase
expression in resected metastases of colorectal cancer. Eur J Cancer 2002; 38
(4): 527–34.
19. Bertino J, Banerjee D. Is the measurement of thymidylate
synthase to determine suitability for treatment with 5-fluoropyrimidines ready
for prime time? Clin Cancer Res 2003; 9: 1235–9.
20. Allegra CJ, Parr AL,
Wold LE et al. Investigation of the prognostic and predictive value of
thymidylate synthase, p53, and Ki-67 in patients with locally advanced colon
cancer. J Clin Oncol 2002; 20: 1732–43.
21. Fujii R, Seshimo A, Kameoka S.
Relationships between the expression of thymidylate synthase, dihydropyrimidine
dehydrogenase, and orotate phosphoribosyltransferase and cell proliferative
activity and 5-fluorouracil sensitivity in colorectal carcinoma. Int J Clin
Oncol 2003; 8: 72–8.
22. Peters GJ, Backus HH, Freemantle S et al. Induction
of thymidylate synthase as a 5-fluorouracil resistance mechanism. Biochim
Biophys Acta 2002; 1587: 194–205.
23. Edler D, Glimelius B, Hallstrom M et
al. Thymidylate synthase expression in colorectal cancer: a prognostic and
predictive marker of benefit from adjuvant fluorouracil-based chemotherapy. J
Clin Oncol 2002; 20: 1721–8.
24. Sobrero A, Aschele C, Bertino JR.
Fluorouracil in colon cancer: a tale of two drugs: implication for biochemical
modulation. J Clin Oncol 1997; 15: 368–81.
25. Araki Y, Isomoto H, Shirouzu
K. Dihydropyrimidine dehydrogenase activity and thymidylate synthase level are
associated with response to 5-fluorouracil in human colorectal cancer. Kurume
Med J 2001; 48 (2): 93–8.
26. Farrugia DC, Ford HER, Cunningham D et al.
Thymidylate synthase expression in advanced colorectal cancer predicts for
response to Raltitrexed. Clin Cancer Res 2003; 9: 792–801.
27. Peters GJ, van
Triest B, Backus HH et al. Molecular downstream events and induction of
thymidylate synthase in mutant and wild-type p53 colon cancer cell lines after
treatment with 5-fluorouracil and the thymidylate synthase inhibitor
raltitrexed. Eur J Cancer 2000; 36 (7): 916–24.
28. Van Triest B, Pinedo HM,
Giaccone G, Peters GJ. Downstream molecular determinants of response to
5-fluorouracil and antifolate thymidylate synthase inhibitors. Ann Oncol 2000;
11 (4): 385–91.
29. Patterson AV, Talbot DC, Stratford IJ, Harris AL.
Thymidine phosphorylase moderates thymidine-dependent rescue after exposure to
the thymidylate synthase inhibitor ZD1694 (Tomudex) in vitro. Cancer Res 1998;
58: 2737–40.
30. Brienza S, Bensmaine MA, Soulie P et al. Oxaliplatin added
to 5-fluorouracil-based therapy (5-FU +/- FA) in the treatment of
5-FU-pretreated patients with advanced colorectal carcinoma (ACRC): results from
the European compassionate-use program. Ann Oncol 1999; 10 (11): 1311–6.
31.
Lichinitser M, Garin A, Gorbunova V et al. Oxaliplatin (Oxa) combined with
4-hour 5-fluoro-uracil (5-FU) infusion and folinic acid (FA) every 2 weeks in
patients with metastatic colorectal cancer (MCRC). Proc Am S Clin Oncol 2001;
20: 143a. Abstract 569.
32. Bras-Goncalves RA, Pocard M, Formento JL et al.
Synergistic efficacy of 3n-butyrate and 5-fluorouracil in human colorectal
cancer xenografts via modulation of DNA synthesis. Gastroenterology 2001; 120
(4): 874–88.
33. Schmitz JC, Yu D, Agrawal S, Chu E. Effect of 2'-O-methyl
antisense ORNs on expression of thymidylate synthase in human colon cancer RKO
cells. Nucleic Acids Res 2001; 29 (2): 415–22.
|