Фотофизические свойства
В первую очередь для
соединений с предполагаемой биологической активностью нами
исследуются их фотофизические свойства в различных средах

От свойства вещества флюоресцировать зависит его
способность генерировать активные токсические факторы при
облучении. Чем меньше флюоресценция, тем выше квантовый выход
интерконверсии, и тем выше фотодинамическое действие ФС при
прочих равных условиях [23]. Однако, для целей флюоресцентной
диагностики опухолей при избирательном накоплении в них ФС,
необходимо сохранять у соединения некоторую, пусть небольшую,
способность флюоресцировать
Цитотоксичность и цитофототоксичность in
vito
Для дальнейшего
определения пригодности соединения для использования в
качестве эффективного ФС для ФДТ определяются его коэффициент
распределения в системе октанол/буферный раствор,
цитотоксичность и цитофототоксичность in vito .
Согласно литературным данным [2, 24], наибольшую
эффективность в качестве ФС для ФДТ проявляют амфифильные
соединения, для которых коэффициент распределения в системе
1-октанол/фосфатный буфер с рН 7.4 (Кр) больше 1. Для
приведенных в таблице 3 ФС этот показатель находится в
диапазоне от 1 до 53, что, при полном сохранении
водорастворимости, является признаком перспективности
дальнейшего изучения свойств этих соединений.
Исследование влияния на клеточное деление и
цитофототоксической активности синтезированных соединений
проводилось in vitro путем МТТ-теста в культуре клеток
феохромоцитомы крысы (линия РС 12). Препаратом сравнения
служил разрешенный для клинического тестирования препарат
"Фотосенс" (ГНЦ РФ НИОПИК). Для возбуждения ФС был использован
лазер SHG YAP:2 с длинной волны испускания 670 нм, причем
экспозиционная доза облучения составляла 20 Дж/см2.
Результатом данных экспериментов явилось заключение о том,
что "Фотохлорин I" и "Фотохлорин II" в небольшой степени, а
"Фотосенс" значительно стимулируют клеточное деление,
"Фотохлорин III" же, напротив, его подавляет. Следовательно,
для "Фотохлорина I", "Фотохлорина П" и "Фотосенса" можно
ожидать в определенных условиях эффекта стимуляции опухолевого
роста, а для "Фотохлорина III" - заметного цитостатического
действия. Однако, для окончательных выводов необходимо
проводить исследование различными методами (напимер, путем
МТТ-теста и по включению 3Н-тимидина в клеточную ДНК) по
крайней мере на двух-трех разных клеточных культурах.
При облучении клеточной культуры, инкубированной с ФС,
наступает гибель клеток. Ее можно оценить по величине
половинной эффективной концентрации, т. е. такой концентрации,
при которой погибает около половины всех клеток. В приведенном
здесь примере ФС по эффективности распределяются следующим
образом: "Фотохлорин III" > "Фотосенс" > "Фотохлорин I"
> "Фотохлорин П". Что касается абсолютных значений, то ФС с
цитофототоксичностью менее 20 nM считаются эффективными
[2].
Острая токсичность и пирогенность in
vivo
Обнадеживающие
результаты по цитофототоксичности способствовали дальнейшему
изучению препаратов на предмет их острой токсичности и
пирогенности in vivo. Исследование токсичности проводили на
мышах, а пирогенности - на кроликах , после однократного внутривенного
введения препаратов в виде 0,5%-ного водного раствора.
При изучении острой токсичности проводили наблюдение за
животными, оценивали сроки гибели, число павших животных,
клиническую картину интоксикации, поведенческие реакции,
макроскопическое состояние внутренних органов павших животных.
ЬВзо расчитывали с помощью метода пробит-анализа. Полученные
результаты позволяют отнести исследованные ФС к классу
соединений "малотоксичные", для которых ЬВ5о (мг/кг) находится
в диапазоне 101-1000.
При испытании на пирогенность установлено, что в тест-дозе
1,75 мг ФС на кг массы тела кролика "Фотохлорин П" и
"Фотохлорин III" апирогенны. Эта тест-доза соответствует
общепринятым дозам для определения пирогенности - 1/20 от
терапевтической дозы для человека (35 мг ФС (0,5 мг/кг) -
рекомендуемая терапевтическая доза). Для "Фотохлорина I"
установлена несколько более высокая пирогенность. Препарат
хорошо переносился животными и не вызывал пирогенности в
тест-дозе 1,00 мг ФС на кг массы тела животного.
Фармакокинетика
При введении препаратов
внутрибрюшинно мышам с перевитой в мышцу задней ноги
эмбриокарциномой Т36 в дозе 40 ("Фотохлорин I") или 50
("Фотохлорин П") мг/кг наблюдаются следующие закономерности в
распределении соединений. После введения препарат попадает в
кровь, а затем перераспределяется в органы и ткани животных.
Практически во всех органах и в опухоли концентрация ФС
достигает своих максимальных значений через 0,5 часа после
введения , после однократного внутривенного
введения препаратов в виде 0,5%-ного водного раствора.
Отличительной особенностью распределения "Фотохлорина I" в
органах является значительное накопление его в тонком
кишечнике - в 2,5-5 раз больше, чем в других органах. Однако,
этот процесс протекает кратковременно, и уже через 18 часов
после введения концентрация в тонком кишечнике уменьшается на
два порядка. Индекс контрасности (отношение концентраций в
опухоли и окружающей нормальной ткани) равен 3-4. Максимальные
различия отмечались через 5 часов после введения
препарата.
Отличительной особенностью распределения "Фотохлорина П" в
органах является его быстрое накопление в селезенке - в 10-30
раз больше, чем в других органах. Через 2 часа этот препарат
перераспределяется в печень и почки, а через 4 часа - в тонкий
кишечник и кровь. Однако, данный процесс также протекает
кратковременно, и уже через 8 часов после введения содержание
препарата в органах и тканях падает более, чем в 10 раз.
Индекс контрасности (отношение концентраций в опухоли и
окружающей нормальной ткани) равен 8-12. Максимальные различия
отмечались через 4 часа после введения препарата. Недостатком
этого соединения является его сильное удерживание тканями
брюшной полости при внутрибрюшинном введении, из-за чего
абсолютные величины накопления в опухоли невелики. Возможно,
этот недостаток не будет играть роли при внутривенном
введении.
Основной путь выведения препаратов из организма через
кишечник. Почки также принимают участие в выведении соединений
из организма.
Подавляющее
количество введенной дозы выводится в течение первых суток.
Применяемый в настоящее время препарат "Фотосенс" сохраняется
в организме в течение более 90 суток, что создаёт значительные
трудности при его использовании ввиду опасности светового
стресса.
Полученные данные позволяют предположить, что оптимальным
временем, по истечении которого можно проводить ФДТ с
применением "Фотохлорина I" и "Фотохлорина П", является,
соответственно, 5 и 4 часа после введения.
Фотодинамическая терапия
Изучение фото динамической
активности препарата "Радахлорин, 0,35%-ный раствор для
внутривенного введения" было проведено на мышах линии Balb/С
весом 20-21 грамм с перевитой внутримышечно в бедро задней
лапы эмбриокарциномой Т36. Вес опухолей в контрольной и
опытной группе в момент эксперимента варьировал от 0,9 до 1
грамма. Процедуру облучения проводили диодным лазером
МЛ-500-СП (производства компаний "Милон" и "Сигм Плюс",
Россия) через 2 недели после перевивки опухоли. Перед началом
облучения была проведена предварительная депиляция кожи в
области облучения.
Соединение вводили внутрибрюшинно в дозе 40 мг/кг веса, что
соответствует достаточной терапевтической дозе. Для проведения
процедуры облучения мыши вводились в эфирный наркоз. Облучение
проводили через 5-6 часов после введения ФС. Каждое животное
подвергалось однократной процедуре облучения при средней
плотности экспозиционной дозы облучения 150 или 300 Дж/см2 ,
после чего проводились наблюдения в течение месяца с
регистрацией площади некроза опухолей и общего
физиологического состояния.
Наилучшие результаты в виде полного некроза опухоли,
образования струпа через 1 неделю после ФДТ и его отпадания
через 1,5 месяца наблюдались в группе, получившей световую
дозу 300 Дж/см2.
Полученные
результаты позволяют констатировать факт наличия выраженной
фото динамической активности данного соединения в
экспериментах т in vivo на мышах.
Выводы
Хлориновые тетрапиррольные
фотосенсибилизаторы обладают интенсивной полосой поглощения в
длинноволновой области, оптимальным соотношением флюоресценция
/ интерконверсия и проявляют на порядок большую световую
токсичность, чем большинство ФС, при отсутствии темновой
токсичности.
Общие токсические свойства при введении хлориновых ФС в
организм оказываются лучше, чем у порфириновых олигомеров или
сульфированных фталоцианинов, а скорости выведения препаратов
из организма не сравнимы: "Фотосенс" и "Фотогем" сохраняются в
организме на период более трёх месяцев против 2-х суток у
водорастворимых хлориновых ФС.
Максимум накопления препаратов в опухоли наступает через
4-5 часов после введения при терапевтическом отношении 3-4 для
"Фотохлорина I" и8- 12- для "Фотохлорина II".
"Фотохлорин I" обладает
выраженной специфической активностью при ФДТ т У/УО, приводя в
эксперименте с животными к полному некрозу опухоли. Этот
результат был во многом достигнут благодаря рабочим
характеристикам лазера МЛ-500СП (производства компаний "Милон"
и "Сигм Плюс", Россия). Таким образом, осуществляемый нами
структурно-функциональный поиск позволяет в итоге получать
фотосенсибилизаторы с хорошими фотофизическими, биологическими
характеристиками и высокой специфической активностью, что
создает возможность для получения ФС, наделенного комплексом
оптимальных для ФДТ свойств.
Изучение эффективности фотодинамической
терапии с новым фотосенсибилизатором фотодитазином -
производным хлорина Е6
Изучали эффективность
фотодинамической терапии (ФДТ) с новым фотосенсибилизатором
хлоринового ряда фотодитазином. Фотодитазин - это глюкаминовая
соль хлорина еб, хорошо растворимое в воде соединение, длина
волны поглощения - 662 нм. Обладает высокой фотодинамической
активностью, большим коэффициентом контрастности (отношение
концентрации в опухоли и нормальной ткани составляет 10:1),
быстрым клиренсом (через сутки в организме остается 6% от
введенного количества, через 2 суток)
Изучение эффективности фотодинамической терапии с новым
фотосенсибилизатором фотодитазином - производным хлорина еб
проведено по 2 протоколам:
- При первичном и рецидивном раке кожи;
- С паллиативной целью для реканализации при обтурирующем
раке пищевода, кардиального отдела желудка, трахеи, крупных
бронхов. В качестве фотосенсибилизатора применяли
фотодитазин в дозах от 0,3 до 1,5 мг/кг. Средняя доза
составила 0,8 мг/кг. Минимальная эффективная доза - 0,3
мг/кг.
Использовали диодные лазеры "Милон" с выходной мощностью
2,5 Вт, l=662 нм (производство ООО "Сигм Плюс & Милон",
Россия) и "Ceralas" (производство фирмы CeramOptek, Германия)
с выходной мощностью 1,0 Вт, l=662 нм, а также твердотельный
лазер на алюминате иттрия Полюс-2 с выходной мощностью до 2
Вт, l=670 нм (производство НИИ "Полюс", Россия).
Плотность мощности при наружном облучении составляла 0,2
-0,3 Вт/см2, плотность энергии 180 - 240 Дж/см2. При ФДТ
внутренних органов плотность энергии колебалась от 75 до 275
Дж/см2.
С целью
реканализации ФДТ повторяли через 7-14 дней, добиваясь
поэтапного восстановления просвета трубчатого органа. Из 72
больных 54 проведено по одному курсу ФДТ, 2 курса ФДТ
проведено 11, а 3 - 5 курсов ФДТ - 7 больным. Всего 72 больным
проведено 104 курса ФДТ: 101 с внутривенным введением
фотодитазина, 3-е внутритканевым (таблица 1).
Оценка непосредственных результатов проводилась через 2
месяца после окончания лечения по критериям ВОЗ:
- Заключение о полной резорбции (ПР) делалось при
отсутствии визуальных и пальпаторных признаков опухолевого
роста, что подтверждалось негативными результатами
морфологических исследовании;
- Заключение о частичной резорбции (ЧР) делалось в случае
уменьшения максимального размера опухолевого узла на 50%, а
также когда при клинически полном отсутствии опухоли,
морфологические исследования выявляли опухолевые клетки;
- Уменьшение опухоли меньше чем наполовину или отсутствие
изменения размеров опухоли расценивалось как отсутствие
эффекта (БЭ).
. Полная резорбция достигнута у 44 больных,
частичная - у 28, включая 15 пациентов, получавших ФДТ с
паллиативной целью: 12 с целью реканализации пищевода, кардии,
трахеи и бронхов и у 3 с распространенным раком рото- и
носоглотки.
Как видно из таблиц, ФДТ с фотодитазином во всех случаях
приводила к развитию терапевтического эффекта. Отсутствия
эффекта отмечено не было. При проведении ФДТ по радикальной
программе у больных первичным и рецидивным раком кожи полная
резорбция достигнута в 82,9% случаев. При лечении
злокачественных опухолей гортани полная резорбция
констатирована в 80% случаев.
При проведении паллиативной ФДТ при обтурирующих опухолях
внутренних органов эффект ФДТ выражался в значительном
улучшении состояния больных. В результате ФДТ у 8 больных
раком пищевода получен выраженный эффект реканализации с
восстановлением питания через рот. Трое из них в течение
первого месяца прибавили в весе 15-20%. Эффект реканализации
сохранялся 3 - 7 месяцев.
У всех больных раком легкого получен выраженный эффект
реканализации с ликвидацией одышки и стридорозного дыхания с
3-4 суток после ФДТ. При контрольной бронхоскопии после
первого курса ФДТ отмечалось частичное (50%) восстановление
просвета бронхов, после 2-3 курса - полное восстановление
просвета с рентгенологически определяемой ликвидацией явлений
гиповентиляции и ателектаза и восстановлением прозрачности
(воздушности) легочной ткани.
Среди больных с рецидивом плоскоклеточного рака языка и
слизистой полости рта и рецидивом плоскоклеточного рака
носоглотки после лучевой терапии, которым было проведено по 2
курса ФДТ с интервалом 2-2,5 месяца, у одного больного удалось
добиться полной резорбции опухоли, и у двух - частичной
резорбции. На 104 курса ФДТ отмечено 20 осложнений: озноб - у
18 больных, в том числе у 3 с подъемом температуры тела до
38°С, тошнотой, рвотой; головокружение, слабость у 1 (у
пациентки 74 лет); у одного больного на 3 день после ФДТ
появился герпес. Озноб у большинства больных был легким,
развивался через 20 - 75 минут после введения препарата и
длился от 5 до 30 минут.
Заключение
Быстрое выведение
фотодитазина из организма разрешает проблему кожной
фототоксичности, свойственную большинству применяемых в
клинике фотосенсибилизаторов.
Благодаря быстрому накоплению в опухоли с высоким
градиентом контрастности между опухолевой и нормальной тканью,
фотодитазин позволяет сократить всю лечебную процедуру с
нескольких суток до 2 - 3 часов. Это свойство фотодитазина,
наряду с высоким коэффициентом контрастности и имеющимися
недорогими портативными надежными диодными лазерами с
соответствующей длиной волны света, делает его весьма
привлекательным фотосенсибилизатором для ФДТ.
Применение ФДТ с фотодитазином для лечения рака кожи
приводит к наступлению полной резорбции опухоли у 83% больных.
ФДТ с фотодитазином можно с
успехом применять с паллиативной целью у пациентов с
распространенным опухолевым процессом в пищеводе,
проксимальном отделе желудка, трахее, крупных бронхах, рото- и
носоглотке.
Апробация нового
противоопухолевого препарата-фотосенсибилизатора "Фотодитазин"
для лечения онкологических заболеваний методом
фотодинамической терапии
Задачи
исследования:
- Оценить эффективность фотодинамической терапии с
препаратом Фотодитазин у экспериментальных животных
опухоленосителей в зависимости от:
- - дозы Фотодитазина
- - плотности падающей энергии
- Выявить наиболее эффективные условия проведения
фотодинамической терапии.
Фотодитазин, представляет собой Д - метилглюкоминовую соль
хлорина Е6, производится фирмой "BETA - ГРАНД" по технологии
разработанной профессором Г.В. Пономарёвым из Института
биомедицинской химии РАМЫ.
Работа выполнена на 270 беспородных крысах массой 130-150 г
и 20 мышах весом 20-22 г, которым под кожу в область бедра
прививали: саркому М-1, рак молочной железы (РМЖ), меланому.
Животных брали в опыт на 7-10 сутки после прививки опухоли.
Фотодитазин вводили внутрибрюшинно в дозах: 0,5; 2,5; 5,0;
10,0 мг/кг. Перед облучением шерстный покров в зоне
опухолевого роста депилировали. Опухоль накротизированных
животных облучали через 2,5-3 часа с помощью: лампы АТО-150
(мощность - 0,186 Вт, Я, - 670 нм), полупроводникового
диодного лазера для фотодинамической терапии - "Suny"
(мощность - 0,350 Вт, Х-662 нм), лазерного аппарата "Аткус-2"
(мощность 0,750 Вт, А,-662 нм). Плотность падающей энергии
составляла от 1 50, 200, 300, 400, 600 Дж/см2.
Фотодинамический эффект Фотодитазина оценивали на 3, 7, 10,
14, 21 сутки после ФДТ по коэффициенту абсолютного прироста
опухоли (К) и по эффекту ингибирования роста опухоли
(Рекомендации Фармкомитета по предклинической апробации
препаратов, 2000г.).
Коэффициент абсолютного прироста опухоли
рассчитывали:
К=
d
1,2,3 - три взаимно
перпендикулярных диаметра опухоли,
1/6p=0,52 - величина
постоянная; V
0 - объем опухоли до воздействия,
V
t - объем опухоли на срок наблюдения.
Для оценки эффективности ингибирования роста вычисляли
средний объем опухоли в группе. Степень ингибирования роста
опухоли определяли по показателю торможения роста опухоли ТРО:
, где V - средний объем опухоли в см3.
Для определения количественного критерия оценки
ингибирующего эффекта кроме ТРО учитывали процент полной
регрессии (ПР) опухоли. Количественные критерии оценки
ингибирующего эффекта
ТРО <20%
0
ТРО
< 20-50%
+-
ТРО < 51-80%
+
ТРО <81-90%
++
ТРО <91 -100% + < 50% ПР/излечения
+++
ТРО <91 -100% + >50%
ПР/излечения ++++
Фотодинамическая терапия меланомы
мышей.
Специфическая
активность 0,5% раствора Фотодитазина исследована на 16 мышах
весом 20-22 г с перевитой меланомой под кожу бедра задней
лапы. Фотодитазин в дозе 5, 10 мг/кг вводили внугрибрюшинно за
2,5 часа до облучения. Животных, находящихся под наркозом,
облучали с помощью аппарата "Suny" (мощность 0,35 Вт, l-662
нм, Е=200,300,400 Дж/см2). Наблюдение за динамикой развития
меланомы представлено в . Из таблицы видно, что к 18-21
суткам после перевивки в контроле начинается гибель мышей с
меланомой. После ФДТ (5 мг/кг, Е=200 Дж/см2) динамика развития
опухоли совпадала с таковой в контроле. Увеличение плотности
мощности до 300 Дж/см обеспечивало существенное торможение
роста меланомы. Коэффициент абсолютного прироста опухоли на 14
сутки был равен практически единице, а в контроле уже на 10
сутки - 46,91. О высокой степени торможения роста меланомы
мышей свидетельствуют результаты, полученные после введения
Фотодитазина в дозе 10 мг/кг и облучения опухоли световой
дозой 400 Дж/см2. Результаты экспериментов, выполненных на
мышиной меланоме, показывают наличие высокой специфической
активности препарата Фотодитазин.
Фотодинамическая терапия рака молочной
железы.
С целью
выбора оптимального время облучения опухоли молочной железы
после внутрибрюшинного введения Фотодитазина было проведено
исследование по накоплению препарата в опухоле.
Накопление Фотодитазина в опухоли определяли с помощью
спектрометра "ЛЭСА-2" у 5 крыс опухоленосителей РМЖ на 10
сутки после ее перевивки. Интенсивность флюоресценции опухоли
регистрировали над центром ее и на границе с окружающими
тканями, т.е. по периферии опухоли, через каждые 15 минут на
протяжении 2-х часов после введения препарата в дозе 10 мг/кг
и оценивали как + -слабое; ++ - хорошее;+++ - отличное.
Oтличное (+++)
накопление препарата в опухоли наблюдалось через 1 час 15
минут в 3-х случаях из 5, а в 2-х случаях - слабое. В двух
случаях зарегистрировано отличное накопление препарата через 1
час 30 минут по всей поверхности опухоли п.1 (голова) и по
периферии ее п.З (хвост). В одном случае п.5 (чистая) отличное
накопление препарата зарегистрировано через 2 часа. После
лазерного облучения флюоресценции в опухолях не обнаружено.
Следовательно, время облучения после введения препарата
необходимо определять индивидуально. Из-за отсутствия такой
возможности в дальнейшей работе мы использовали интервал 2,5-3
часа между введением препарата и облучением опухоли.
Результаты ФДТ рака молочной железы крыс представлены в и рисунке 1, из которых видно, что
после фотодинамической терапии наблюдалось достоверное
торможение коэффициента абсолютного прироста опухоли по
сравнению с контролем.
и рисунке 1, из которых видно, что
после фотодинамической терапии наблюдалось достоверное
торможение коэффициента абсолютного прироста опухоли по
сравнению с контролем.
Объем
опухоли в группе животных, которым вводили Фотодитазин в дозе
5 мг/кг (Е=200 Дж/см2) уменьшился с 97% до 82% (14 сутки). К
21 суткам показатель торможения опухоли снизился до 69%, но
при этом вырос процент полной регрессии (60%).
Увеличение дозы препарата в
два раза (до 10 мг/кг) при той же дозе лазерного облучения
(200 Дж/см2) или же увеличение дозы лазерного облучения до 300
Дж/см2 при той же дозе препарата (5 мг/кг) обеспечило 100%
регрессию опухоли РМЖ.

Фотодинамическая терапия саркомы М-1 после
внутрибрюшинного введения Фотодитазина
Кинетика 0,35% Фотодитазина,
введенного внутрибрюшинно в дозе 5 мг/кг, прослежена у 3-х
крыс на протяжении 1 недели. Накопление препарата определяли с
помощью спектрофлюоресцентного комплекса "LESA-6" в центре
опухоли и в аналогичных точках по периферии ее. Контролем
служила точка на другом бедре. Время накопления препарата
имеет индивидуальные колебания, которые в среднем укладываются
в промежутке 2,5-6 часов. Учитывая полученные данные облучение
саркомы М-1 проводили через 2,5-3 часа после введения
Фотодитазина в дозах: 0,5, 2,5, 5, 10 мг/кг  рисунок
2).
рисунок
2).
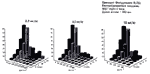
Из таблиц видно, что при всех использованных дозах
препарата (кроме 0,5 мг/кг; 300 Дж/см2): 2,5; 5,0; 10,0 мг/кг
и при всех дозах плотности падающей энергии: 150, 200, 300,
400, 600 Дж/см2 наблюдается достоверное снижение коэффициента
абсолютного прироста опухоли и естественно высокий процент
торможения её роста, наблюдается регрессия опухоли от 28,6% до
98,7% и ингибирующий эффект от + до ++++.
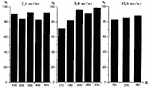
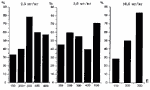
Анализ результатов исследования выявили 5 наиболее
эффективных вариантов доз препарата и падающей энергии для ФДТ
(2,5 мг/кг и 5,0 мг/кг - 300 и 600 Дж/см2). 4 из них имеют
одинаково высокий ингибирующий эффект (++++). В пятом варианте
- 10мг/кг; 300 Дж/см2 выявлен наиболее высокий процент полной
регрессии опухоли, но при этом процент торможения роста
опухоли не позволяет высоко оценить ингибирующий эффект
данного варианта. Процент торможения роста опухоли и процент
полной регрессии на 21 сутки представлены на рисунках 3,
4.
На основании представленного материала можно сделать
выводы:
- Фотодитазин является высокоэффективным
фотосенсибилизатором для проведения фотодинамической
терапии.
- Эффективность Фотодитазина зависит от дозы препарата и
плотности падающей энергии.
- Наиболее выраженный противоопухолевый эффект получен при
дозе препарата 2,5 и 5 мг/кг, Е=300, 600 Дж/см2.
- Самая малая и эффективная для ФДТ доза препарата и доза
энергии из исследованных нами - 2,5 мг/кг, 300 Дж/см2.
Заключение
Фотодитазин активно
накапливается в опухоли экспериментальных животных. В опухоли
молочной железы крыс наибольшее накопление зарегистрировано
через 1 час 15 минут - 2 часа, в саркоме М-1 - через 2,5 - 3
часа.
Результаты фотодинамической терапии, выполненные с
Фотодитазином, свидетельствуют об отличном ингибирующем
эффекте при введении в дозе 2,5, 5 мг/кг и облучении с
плотностью мощности 300, 600 Дж/см2.
Таким образом, результаты
проведенных исследований позволяют сделать вывод о том что,
Фотодитазин является высокоэффективным
фотосенсибилизатором.
Динамика роста саркомы М-1 после
фотодинамической терапии с Фотодитазином и с последующим
применением фитококтейля Формула -1 и Формула-2.
Выполнено 4 группы
эксперимента, в каждой группе было по 8 животных. Животным
I-III групп провели ФДТ с Фотодитазином. Животным I группы
после ФДТ давали фитококтейль Формула-1, II группе животных
после ФДТ давали фитококтейль Формула-2, III группе животных
проведена только фотодинамическая терапия, IV группа -
интактные опухоленосители саркомы М-1 (контроль).
ФДТ проводили через 3 часа после внутрибрюшинного введения
Фотодитазина в дозе 5 мг/кг, при плотности падающей энергии
300 Дж/см2, на следующие сутки и до конца наблюдения животные
получали ежедневно фитококтейль Формула-1 или Формула-П через
зонд в дозе 0,1 мг/100 г массы животного и 0,1 мл/100г в
поилку.
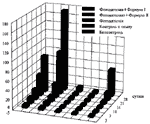
Из рисунка 5 видно, что во всех
группах на все сроки исследования наблюдается достоверное
снижение коэффициента абсолютного прироста опухоли. Высокий
процент торможения опухоли отмечен во всех группах до 14 суток
(от 95% до 99%), отсутствие опухолевого роста зарегистрировано
от 62% до 75%, ингибирующий эффект (I i i I) оценивается как
высокий.
К 28 суткам лучшие результаты в лечении саркомы М-1
наблюдаются в группе с ФДТ+Формула-2 (самый низкий коэффициент
абсолютного прироста опухоли 1,02 по сравнению с другими
группами опыта), самый высокий процент торможения опухоли 99%,
самый высокий процент полной регрессии 75% и соответственно
ингибирующий эффект В группе ФДТ+Формула-1 начиная с 21 суток
(рисунок 3) коэффициент абсолютного прироста опухоли выше, чем
в двух других опытных группах. Ингибирующий эффект (++)
оценивается как удовлетворительный в связи со снижением
процента торможения роста опухоли (86%) и процента полной
регрессии опухоли (50%).
В группе ФДТ процент полной регрессии опухоли также падает
(от 50% до 43%), однако процент торможения роста остается
высоким (97%) и соответственно ингибирующий эффект остается
хорошим (+++).
Таким образом
применение коктейля Формула-2 повышает результаты
фотодинамической терапии. Применять коктейль Формула-1 сразу
после ФДТ, по-видимому, не следует, поскольку рост опухоли
усиливается по сравнению с результатами ФДТ без применения
коктейля.
Фотодинамическая терапия рака с
использованием фотосенсибилизатора "Радахлорин" и лазерных
диодных модулей ML500-SP (662 НМ) И SUNNY (PDT-662)
Впервые водорастворимые
производные хлорофилла для медицинских целей были использованы
Е. Snyder (США) в 1942 г., и со временем они стали применяться
для профилактики и лечения сердечно-сосудистых заболеваний,
атеросклероза, ревматоидного артрита.
В научной литературе об использовании производных
хлоринового ряда для фотодинамической терапии было заявлено в
1986 г., после чего группа авторов из США (J. Bommer, Z.
Sveida и В. Burnham) создала моно-1_-аспартил хлорин е6
(МАСЕ), который в настоящий момент находится на завершающей
стадии клинических испытаний в Японии.
В 1994-2001 гг. в России А.
В. Решетниковым была разработана технология извлечения из
растительного сырья комплекса биологически активных хлоринов,
которые содержат в качестве основного компонента хлорин е6,
фотоцитотоксическое действие которого на опухоль усиливается,
а общие фармакологические показатели улучшаются за счет двух
других природных хлоринов, содержащихся в экстракте. Хлорины,
в виде 7%-ного водного раствора, представляют собой субстанцию
"Радахлорин", используемую для приготовления различных
лекарственных форм, в том числе раствора радахлорина для
внутривенного введения и геля радахлорина для наружного
применения. Данные препараты запатентованы и производятся ООО
"РАДА-ФАРМА" (Москва, Россия) совместно с ООО "Фирма ГЛЕС"
(Москва, Россия) и Российским онкологическим научным центром
им. Н. Н. Блохина РАМН и в 2000 г. перешли на стадию
ограниченных клинических испытаний у добровольцев и пациентов
с неотложными жизненными показаниями.
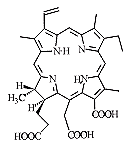
"Радахлорин" содержит композицию из трех циклических
тетрапирролов хлориновой природы (с гидрированным кольцом D),
основной из которых (80-90 %) - хлорин е6 (рис, 1,2). В
дополнение к нему имеется ФС, обладающий способностью с
высокой избирательностью накапливаться в неопластических
образованиях и абсцессах, а также возможен примесный компонент
(<5 %). Для "Радахлорина" характерна высокая
водорастворимость и хорошая стойкость при хранении. Хранение
"Радахлорина" в темноте при 4-8 °С не меняет его свойств в
течение полутора лет.
1. Фотофизические
свойства "Радахлорина"
Фотосенсибилизаторы (ФС) обладают способностью поглощать
свет в видимой области, результатом чего является их
фотоактивация и последующая релаксация возбужденного состояния
с переносом энергии на растворенный в тканях молекулярный
кислород и органические субстраты. Последнее приводит к
окислительным и свободнорадикальным процессам в биологических
тканях, их повреждению и последующему разрушению (некрозу).
Наиболее предпочтительной для ФДТ полосой возбуждения является
самая длинноволновая полоса поглощения конкретного ФС, т.к. с ростом длины волны растет проникающая
способность света в биологические ткани.
В первую очередь для
соединений с предполагаемой биологической активностью нами
исследуются их фотофизические свойства в различных
средах.

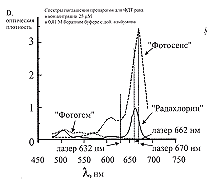
"Радахлорин" способен разрушать биологические субстраты
после возбуждения светом с длиной волны 654-670 нм, чему
соответствует эффективная глубина проникновения света в ткани
до 7 мм (рис. 7).
Высокая степень фототоксичности "Радахлорина" связана с
высоким квантовым выходом интерконверсии , что коррелирует с высоким
квантовым выходом синглетного кислорода -одного из основных
токсических агентов, образующихся под действием света при ФДТ.
Сохраняющаяся при этом способность препарата флюоресцировать
оставляет возможность для люминесцентной диагностики очагов
неопластического изменения тканей. Для этого препарат
возбуждают в любой из полос - 406, 506, 536, 608 или 662 нм и
регистрируют интенсивную флюоресценцию при 668 нм.
2. Результаты биологических
испытаний
2.1.
Исследование цитотоксичности и цитофототоксичности in
vitro
Представленные данные позволяют предположить, что в
отсутствие облучения лазером для "Радахлорина" в небольшой
степени, а "Фотосенса" - в значительной характерно проявление
цитотоксической активности.
При облучении лазером клеточной культуры, инкубированной с
ФС, наступает гибель клеток. Цитофототоксичность соединений
принято оценивать по величине концентрации в микромолях (mМ)
препарата, при которой погибает 50 % всех клеток (ЕС50). В
приведенном здесь примере ФС по эффективности распределяются
следующим образом: "Радахлорин"і"Фотосенс". Что касается
абсолютных значений, то ФС с цитофототоксичностью менее 20 mМ
считаются эффективными.

2.2. Острая токсичность и пирогенность in vivo
Обнадеживающие результаты по
цитофототоксичности способствовали дальнейшему изучению
"Радахлорина" в опытах in vivo.
Исследование токсичности
проводили на мышах
F1(CBAxC57BIT/6), а
пирогенности - на кроликах. "Радахлорин, 0,35%-ный раствор для
внутривенного введения" вводили внутривенно одноразово.
При изучении острой токсичности проводили наблюдение за
животными, оценивали сроки гибели, число павших животных,
клиническую картину интоксикации, поведенческие реакции и
макроскопическое состояние внутренних органов павших животных.
LD50 рассчитывали с помощью метода пробит-анализа.
Полученные результаты позволяют отнести "Радахлорин" к классу
соединений "малотоксичные", для которых LD50
находится в диапазоне 101-1000 мг/кг.
При испытании на
пирогенность установлено, что в тест-дозе 0,70 мг/кг массы
тела кролика "Радахлорин" апирогенен. Эта тест-доза
соответствует общепринятым дозам для определения пирогенности
-1/20 от терапевтической дозы для человека.
2.3. Фармакокинетика
При
введении препарата "Радахлорин, 0,35%-ный раствор для
внутривенного введения" внутрибрюшинно мышам с 'перевитой
внутримышечно эмбриокарциномой Т36 в дозе 40 мг/кг наблюдаются
следующие закономерности в его распределении. После введения
препарат попадает в печень, а затем в кровь, после чего он
перераспределяется в органы и ткани животных . При внутривенном введении
препарата в дозе 20 мг/кг были получены аналогичные
закономерности биораспределения.
Максимум накопления субстанции в опухоли (0,70 mМ)
достигается через 5 часов после внутрибрюшинного введения в
дозе 40 мг/кг и длительно сохраняется (18-24 часа). Опухолевая
концентрация субстанции через 18 часов после введения
препарата составляет 0,48 (iM, что всего в 1,5 раза меньше,
чем в абсолютном максимуме накопления, при высокой
селективности накопления. Отношение опухоль/мышечная ткань
через 18 часов составляет 32, а опухоль/кожа - 44.
После внутривенного введения препарата в дозе 20 мг/кг
максимум накопления в опухоли регистрируется через 0,5 часа
(0,32 иМ) и также длительно сохраняется (до 5 часов).
Максимальная контрастность накопления при внутривенном
введении проявляется через 3 часа и составляет для
опухоли/мышечной ткани 3, а опухоли/кожи - 4.
Препарат выводится из
организма через сутки на 94%.
3. Фотодинамическая терапия
Изучение фотодинамической
активности препарата "Радахлорин, 0,35%-ный раствор для
внутривенного введения" было проведено на мышах линии Balb/C
массой 20-21 г с перевитой внутримышечно в бедро задней лапы
эмбриокарциномой Т36. Вес опухолей в контрольной и опытной
группе в момент эксперимента варьировал от 0,9 до 1 г.
Процедуру облучения проводили диодным лазером ML500-SP через 2
недели после перевивки опухоли. Перед началом облучения была
проведена предварительная депиляция кожи в области
облучения.
Соединение вводили Внутрибрюшинно в дозе 40
мг/кг массы, что соответствует достаточной терапевтической
дозе. Для проведения процедуры облучения мыши вводились в
эфирный наркоз. Облучение проводили через 5-6 часов после
введения ФС. Каждое животное подвергалось однократной
процедуре облучения при средней плотности экспозиционной дозы
облучения 150 или 300 Дж/см2, после чего проводились
наблюдения в течение месяца с регистрацией площади некроза
опухолей и общего физиологического состояния. Наилучшие
результаты в виде полного некроза опухоли, образования струпа
через 1 неделю после ФДТ и его отпадания через 1,5 месяца
наблюдались в группе, получившей световую дозу 300 Дж/см2.
Полученные результаты позволяют констатировать факт наличия
выраженной фотодинамической активности данного соединения в
экспериментах in vivo на мышах.
4. Первые клинические результаты
В клинике общей хирургии
Челябинской государственной медицинской академии (ЧГМА) на
базе городской клинической больницы № 1 метод ФДТ применен у
35 больных (15 мужчин и 20 женщин) для лечения злокачественных
опухолей кожи, молочной железы, желудочно-кишечного тракта,
женских половых органов.
По одному курсу проведено у 33 больных, по два курса у 3
больных, по три курса у одного больного .
У восьми пациентов ФДТ
злокачественной опухоли проводилась в связи с наличием
противопоказаний к традиционным методам лечения: возрастные
изменения, тяжелые сопутствующие заболевания. У 58,2 %
пациентов опухоли имели I и II стадии, в четырех случаях было
первично-множественное поражение одного или нескольких
органов.
Часть больных (5
человек, 137 опухолей) ранее лечились общепринятыми методами
(хирургическая операция, лучевая-, химия-, криотерапия), и
возможности указанных методов при лечении остаточной опухоли,
рецидива или метастазов были исчерпаны. У данных больных ФДТ
производилась не ранее чем через один месяц после лучевой или
лекарственной терапии.
Эффективность ФДТ оценивалась по данным визуального,
эндоскопического, рентгенологического, ультразвукового и
цитоморфологического методов исследований.
Использовались четыре
методики лазерного облучения:
- Дистанционное, поверхностное облучение - с оптического
торца световода или через микролинзу.
- Внутриполостное.
- Внутритканевое.
- Сочетание поверхностного и внутритканевого.
В случаях 2-4 использовались различные световоды и
диффузоры. Лечение производилось под местной анестезией или
внутривенном наркозом.
Эффективность ФДТ
оценивалась непосредственно после окончания сеанса, через 1-2
суток, на седьмой, пятнадцатый, тридцатый день и затем
ежемесячно (рис. 8).
В период от 1 до 7 дней фотохимическая реакция различной
степени выраженности была выявлена в 100 % случаев.
О развитии в опухоли
фотоцитотоксической реакции свидетельствовали: отек и
гиперемия в зоне облучения, нарушение кровообращения с
некрозом опухоли.
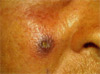
Рис. 8. Динамическое наблюдение больной с
диагнозом "базалиома"
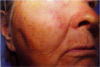
а. До операции
(слева).
б. Через 2 часа. В области правой щеки на месте
базалиомы появился отек и легкая гиперемия на участке до 1,5
см. Самочувствие больной и температура нормальные (справа).
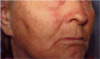
в. Через 1 сутки. Отек в области правой щеки увеличился
(3x2 см). В зоне базалиомы появилась темно-коричневая
поверхностная сухая корочка (слева).
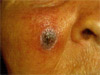
г. Через 7 суток. Отек
в области щеки незначительный, на месте базалиомы струп
темно-коричневого цвета размером 5x7 мм. Самочувствие больной
оставалось хорошим, температура тела в течение 7 дней
оставалась нормальной (справа).
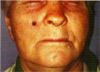
д. Через 4 недели
(14.11.2000 г.). В щечной области справа на месте базалиомы
имеется плотный поверхностный струп темно-коричневого цвета
диаметром 0,7 см. Вокруг имеется узкая полоска гиперемии.
Отека нет, инфильтрации окружающих тканей нет. Пальпация
безболезненная. Температура тела нормальная (слева).
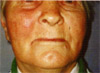
е. Через 6 недель
(28.11.2000 г.). На месте бывшей базалиомы сформировался
поверхностный нежный малозаметный слабопигментированный рубчик
размером 3x4 мм. Отека и инфильтрации ткани щеки нет (справа).
Заключение
Полная резорбция опухоли
(базалиомы) с хорошим косметическим эффектом.
Таким образом,
фотодинамическая терапия с использованием лазерного диодного
модуля с длиной волны 662 нм в сочетании с препаратами
"Радахлорин, 0,35%-ный раствор для внутривенного введения" и
"Радахлорин, 0,1%-ный гель для наружного применения" дает
полную резорбцию опухоли (базалиомы) с хорошим косметическим
эффектом. Положительные результаты также имеются при лечении
многих других нозологии злокачественных новообразований.
5. Выводы
Хлориновые тетрапиррольные
фотосенсибилизаторы обладают интенсивной полосой поглощения в
длинноволновой области, оптимальным соотношением
флюоресценция/интерконверсия и проявляют на порядок большую
световую токсичность, чем большинство ФС, при отсутствии
темновой токсичности. Общие токсические свойства при введении
хлориновых ФС в организм оказываются лучше, чем у порфириновых
олигомеров или сульфированных фталоцианинов, а скорости
выведения препаратов из организма не сравнимы: "Фотосенс" и
"Фотогем" сохраняются в организме на период более 3 месяцев
против 2 суток у водорастворимых хлориновых ФС.
Осуществляемый нами структурно-функциональный поиск
позволяет получать фотосенсибилизаторы с хорошими
фотофизическими, биологическими характеристиками и высокой
специфической активностью, что создает возможность для
получения ФС, наделенного комплексом оптимальных для ФДТ
свойств.
Препарат
"Радахлорин, 0,35%-ный раствор для внутривенного введения"
обладает рядом преимуществ по сравнению с другими препаратами
для ФДТ:
- Достижение высокого (0,70 \mМ) максимума накопления в
опухоли через 5 часов после внутрибрюшинного введения в дозе
40 мг/кг и длительное его сохранение (18-24 часа).
Опухолевая концентрация через 18 часов после введения
составляет 0,48 у.М, что всего в 1,5 раза меньше, чем в
абсолютном максимуме накопления, при исключительно высокой
селективности накопления. Отношение опухоль/мышечная ткань
через 18 часов составляет 32, а опухоль/кожа - 44.
- Постижение высокого (0,32 \mM) максимума накопления в
опухоли через 0,5 часа после внутривенного введения в дозе
20 мг/кг и длительное его сохранение (до 5 часов).
Максимальная контрастность накопления при внутривенном
введении проявляется через 3 часа и составляет для
опухоли/мышечной ткани составляет 3, а опухоли/кожи - 4.
- Быстрое выведение препарата из организма: через сутки -
98 %.
- Высокая фотодинамическая активность препарата in vivo
при низкой цитотоксичности.
В результате проведения ФДТ с "Радахлорином, 0,35%-ным
раствором для внутривенного введения" получено увеличение
средней продолжительности жизни в опытной группе животных,
облученной лазерным излучением 300 Дж/см2, почти в 2 раза при
выраженной деструкции опухолей. Этот результат был во многом
достигнут благодаря рабочим характеристикам лазера ML500-SP.
Свойства "Радахлорина"
позволяют радикально изменить саму технологию ФДТ в
онкологической клинике, поскольку можно исключить этап
продолжительного пребывания в стационаре, необходимый при
использовании "Фотофрина-И", "Фотогема" или "Фотосенса",
заменив его однодневным стационаром или даже амбулаторным
лечением.
Оптимальным временем для облучения опухолей лазерным
излучением в клинике можно считать интервал 0,5-3 часа (при
внутривенном введении).
Фармакопейные статьи
предприятия-производителя ООО "РАДА-ФАРМА" на лекарственную
субстанцию "Радахлорин" и 2 лекарственные формы: "Радахлорин,
0,35%-ный раствор для внутривенного введения" и "Радахлорин,
0,1%-ный гель для наружного применения" (совместно с ООО
"Фирма ГЛЕС", НИИ ЭДиТО РОНЦ РАМН) зарегистрированы
департаментом по новым лекарственным средствам и находятся на
этапе оптимизации параметров.
Препараты "Радахлорин, 0,35%-ный раствор для внутривенного
введения" и "Радахлорин, 0,1%-ный гель для наружного
применения" рекомендованы Ученым Советом РОНЦ им. Н. Н.
Блохина РАМН к первой фазе клинических
испытаний.
Лекция любезно предоставлена Центром лазерной
медицины "Волшебный луч" (Москва).
www.magicray.ru